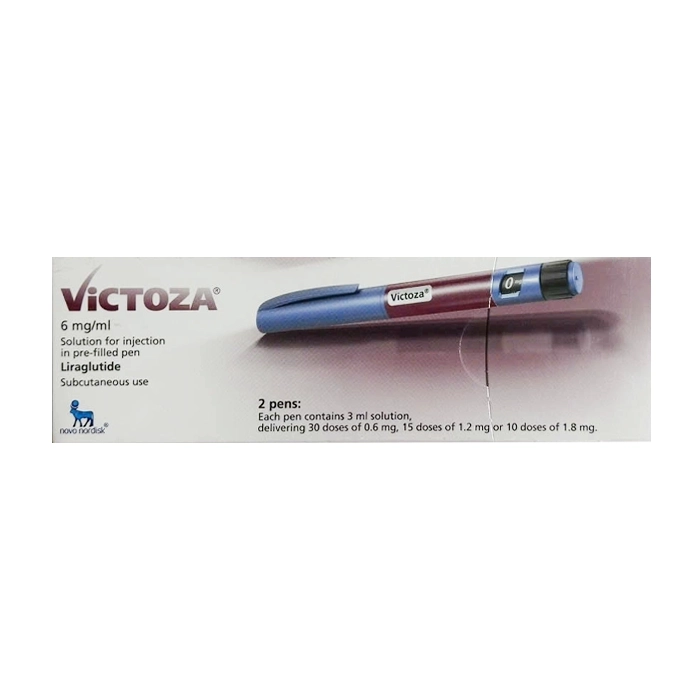
Victoza 6mg/ml Novo Nordisk 2 bút x 3ml
* Hình sản phẩm có thể thay đổi theo thời gian
** Giá sản phẩm có thể thay đổi tuỳ thời điểm
30 ngày trả hàng Xem thêm

Tìm thuốc Liraglutide khác
Tìm thuốc cùng thương hiệu Novo Nordisk khác
Thuốc này được bán theo đơn của bác sĩ
Gửi đơn thuốc.svg)
Bạn muốn nhận hàng trước 4h hôm nay. Đặt hàng trong 55p tới và chọn giao hàng 2H ở bước thanh toán. Xem chi tiết
Thông tin sản phẩm
| Hoạt chất: | |
| Quy cách đóng gói: | |
| Thương hiệu: | |
| Xuất xứ: | |
| Thuốc cần kê toa: | |
| Dạng bào chế: | |
| Hàm Lượng: | |
| Nhà sản xuất: |
Nội dung sản phẩm
Thành phần
- Liraglutide: 6mg.
Công dụng (Chỉ định)
- Victoza được chỉ định để điều trị bệnh đái tháo đường tuýp 2 ở người lớn nhằm đạt được sự kiểm soát mức đường huyết khi dùng phối hợp với các thuốc hạ đường huyết dạng uống và/hoặc với insulin nền, khi các thuốc này cùng với chế độ ăn và luyện tập không đủ để kiểm soát mức đường huyết.
Liều dùng
Để cải thiện khả năng dung nạp dạ dày – ruột, liều khởi đầu là 0,6 mg liraglutide mỗi ngày. Sau ít nhất 1 tuần, nên tăng liều lên 1,2 mg. Một số bệnh nhân có thể có lợi từ sự tăng liều từ 1,2 mg đến 1,8 mg và dựa trên đáp ứng lâm sàng, sau ít nhất 1 tuần có thể tăng liều lên 1,8 mg để cải thiện thêm sự kiểm soát đường huyết. Không khuyến cáo dùng các liều hàng ngày cao hơn 1,8 mg.
Victoza có thể được bổ sung vào trị liệu bằng metformin đang dùng hoặc trị liệu phối hợp metformin và thiazolidinedione. Liều metformin và thiazolidinedione đang dùng có thể được tiếp tục không thay đổi.
Victoza có thể được bổ sung vào trị liệu bằng sulphonylurea hoặc trị liệu phối hợp metformin và sulphonylurea hoặc một insulin nền. Khi bổ sung Victoza vào trị liệu bằng sulphonylurea hoặc insulin nền, cần xem xét giảm liều sulphonylurea hoặc insulin nền để giảm nguy cơ hạ đường huyết
Không cần tự theo dõi đường huyết để điều chỉnh liều Victoza. Tuy nhiên, khi khởi đầu điều trị bằng Victoza phối hợp với một sulphonylurea hoặc một insulin nền, việc tự theo dõi đường huyết có thể trở nên cần thiết để điều chỉnh liều sulphonylurea hoặc insulin nền.
Các nhóm bệnh nhân đặc biệt
- Người cao tuổi (> 65 tuổi): Không cần điểu chỉnh liều dựa trên tuổi tác.
- Kinh nghiệm điều trị ở bệnh nhân ≥ 75 tuổi còn hạn chế
- Suy thận: Không cần điều chỉnh liều đối với bệnh nhân suy thận nhẹ hoặc trung bình (độ thanh thải creatinin lần lượt là 60-90 ml/phút và 30-59 ml/phút). Không có kinh nghiệm điều trị ở những bệnh nhân suy thận nặng (độ thanh thải creatinin dưới 30 ml/phút). Hiện nay Victoza không được khuyên dùng đối với bệnh nhân bị suy thận nặng kể cả bệnh nhân bị bệnh thận giai đoạn cuối
- Suy gan: Kinh nghiệm điều trị ở bệnh nhân suy gan các mức độ hiện nay còn rất hạn chế nên không khuyên dùng ở bệnh nhân bị suy gan nhẹ, trung bình hoặc nặng
- Trẻ em: Sự an toàn và hiệu quả của Victoza ở trẻ em và thiếu niên dưới 18 tuổi chưa được xác định.
Cách dùng
Đường dùng: Tiêm dưới da.
Victoza không được dùng đường tĩnh mạch hoặc tiêm bắp.
Victoza được dùng 1 lần/ngày vào bất kỳ lúc nào, không phụ thuộc vào bữa ăn, và có thể tiêm dưới da vào bụng, đùi hoặc phần trên cánh tay. Có thể thay đổi vị trí tiêm và thời gian tiêm mà không cần điều chỉnh liều. Tuy nhiên, tốt nhất là tiêm Victoza gần như vào cùng một thời điểm trong ngày, khi chọn được thời điểm thuận tiện nhất trong ngày. Để biết thêm hướng dẫn sử dụng, xem thận trọng.
Hướng dẫn sử dụng:



- Không được sử dụng Victoza nếu dung dịch không trong suốt và không màu hoặc gần như không màu.
- Không được sử dụng Victoza nếu sản phẩm đã bị đông lạnh.
- Victoza có thể được dùng với các kim tiêm có độ dài đến 8mm và độ mảnh nhỏ đến 32G.
- Bút tiêm được thiết kế để sử dụng với kim dùng một lần NovoFine hoặc NovoTwist.
- Hộp thuốc không bao gồm kim tiêm.
- Nên hướng dẫn bệnh nhân hủy bỏ kim tiêm theo đúng quy định của địa phương sau mỗi lần tiêm và bảo quản bút tiêm không có kim gắn vào. Việc này nhằm ngăn ngừa nhiễm bẩn, nhiễm khuẩn và rò rỉ thuốc, ngoài ra còn bảo đảm liều dùng chính xác.
Quá liều
- Từ các thử nghiệm lâm sàng và việc sử dụng khi thuốc lưu hành trên thị trường, đã có báo cáo các trường hợp dùng quá liều lên đến 40 lần liều duy trì được khuyến cáo (72 mg). Các biến cố đã được báo cáo bao gồm buồn nôn và nôn nặng. Không có báo cáo nào bao gồm hạ đường huyết nặng. Tất cả bệnh nhân đã phục hồi không có biến chứng.
- Trong trường hợp quá liều, cần bắt đầu điều trị hỗ trợ thích hợp tùy theo các triệu chứng cơ năng và thực thể trên lâm sàng của bệnh nhân.
Không sử dụng trong trường hợp sau (Chống chỉ định)
- Quá mẫn với hoạt chất hoặc bất kỳ thành phần nào của tá dược trong danh mục tá dược.
- Ung thư biểu mô tuyến giáp thể tủy: Chống chỉ định dùng Victoza cho những bệnh nhân có tiền sử bản thân hoặc gia đình bị ung thư biểu mô tuyến giáp thể tủy hoặc bệnh nhân đang bị hội chứng tăng sinh đa tuyến nội tiết típ 2 (MEN2).
Tác dụng không mong muốn (Tác dụng phụ)
Tóm tắt thông tin về an toàn: Trong 5 thử nghiệm lâm sàng lớn dài hạn, trên 2500 bệnh nhân đã được điều trị bằng Victoza đơn độc hoặc phối hợp với metformin, sulphonylurea (có hoặc không có metformin) hoặc metformin cộng rosiglitazone.
Những phản ứng ngoại ý được báo cáo thường xuyên nhất trong các thử nghiệm lâm sàng là rối loạn tiêu hóa: buồn nôn và tiêu chảy là rất thường gặp, trong khi nôn, táo bón, đau bụng và khó tiêu là thường gặp. Lúc bắt đầu điều trị, những phản ứng ngoại ý về tiêu hóa này có thể hay xảy ra hơn. Những phản ứng này thường giảm trong vòng vài ngày hoặc vài tuần khi tiếp tục điều trị. Nhức đầu và viêm mũi họng cũng thường gặp. Hơn nữa, hạ đường huyết cũng thường gặp và rất thường gặp trong trường hợp liraglutide được sử dụng kết hợp với một sulphonylurea. Hạ đường huyết nặng chủ yếu được quan sát thấy khi kết hợp với một sulphonylurea.
Bảng danh sách các phản ứng ngoại ý: Bảng 3 liệt kê các phản ứng ngoại ý của Victoza được báo cáo trong các thử nghiệm pha 3 dài hạn có đối chứng và báo cáo tự phát (hậu mãi).
Tần suất về các báo cáo tự phát có liên quan (hậu mãi) đã được tính dựa trên tỷ lệ mắc trong các thử nghiệm lâm sàng pha 3.
Tần suất được phân loại như sau: Rất thường gặp (≥1/10); thường gặp (≥1/100 – <1/10); ít gặp (≥ 1/1.000 – <1/100); hiếm gặp (≥1/10.000 – <1/1.000); rất hiếm gặp (<1/10.000); không rõ tần suất (không thể xác định được từ các dữ liệu hiện có). Trong mỗi nhóm tần suất, các phản ứng ngoại ý được trình bày theo thứ tự độ nghiêm trọng giảm dần.

- Mô tả các phản ứng ngoại ý chọn lọc: Trong một thử nghiệm lâm sàng với liraglutide đơn trị liệu, tỷ lệ hạ đường huyết được báo cáo với liraglutide thấp hơn tỷ lệ được báo cáo đối với những bệnh nhân được điều trị với thuốc đối chứng (glimepiride). Các phản ứng ngoại ý được báo cáo thường xuyên nhất là rối loạn tiêu hóa, nhiễm khuẩn và nhiễm ký sinh trùng.
- Hạ đường huyết: Hầu hết các cơn hạ đường huyết có chẩn đoán xác định trong các thử nghiệm lâm sàng đều nhẹ. Không quan sát thấy các cơn hạ đường huyết nặng trong nghiên cứu với liraglutide đơn trị liệu. Hạ đường huyết nặng có thể xảy ra không thường xuyên và chủ yếu được quan sát thấy khi liraglutide được phối hợp với một sulphonylurea (0,02 trường hợp/người năm).
- Rất ít cơn hạ đường huyết (0,001 trường hợp/người năm) được quan sát thấy khi dùng liraglutide phối hợp với các thuốc điều trị đái tháo đường khác ngoài sulphonylurea. Nguy cơ hạ đường huyết là thấp khi sử dụng phối hợp giữa insulin nền và liraglutide (1,0 trường hợp/người năm, xem Dược lực học).
- Phản ứng ngoại ý đường tiêu hóa: Khi phối hợp liraglutide và metformin, 20,7% bệnh nhân có ít nhất một cơn buồn nôn và 12,6% bệnh nhân có ít nhất một đợt tiêu chảy. Khi phối hợp liraglutide với một sulphonylurea, 9,1% bệnh nhân có ít nhất một cơn buồn nôn và 7,9% bệnh nhân có ít nhất một đợt tiêu chảy được báo cáo. Hầu hết trường hợp đều từ nhẹ đến trung bình, và xảy ra phụ thuộc vào liều. Khi tiếp tục điều trị, tần suất và mức độ nghiêm trọng giảm ở hầu hết các bệnh nhân ban đầu bị buồn nôn.
- Những bệnh nhân > 70 tuổi có thể gặp các tác dụng ngoại ý ở đường tiêu hóa nhiều hơn khi được điều trị bằng liraglutide.
- Những bệnh nhân bị suy thận nhẹ và trung bình (độ thanh thải creatinine lần lượt là 60-90 ml/phút và 30-59 ml/phút) có thể gặp các tác dụng ngoại ý ở đường tiêu hóa nhiều hơn khi được điều trị bằng liraglutide.
- Ngừng thuốc: Tỷ lệ ngừng thuốc do các phản ứng ngoại ý là 7,8% đối với bệnh nhân được điều trị bằng liraglutide và 3,4% đối với bệnh nhân được điều trị bằng thuốc đối chứng trong các thử nghiệm dài hạn có đối chứng (26 tuần hoặc lâu hơn). Các phản ứng ngoại ý thường gặp nhất dẫn đến ngừng thuốc đối với bệnh nhân được điều trị bằng liraglutide là buồn nôn (2,8% bệnh nhân) và nôn (1,5%).
- Phản ứng tại vị trí tiêm: Phản ứng tại vị trí tiêm đã được báo cáo trong 2% đối tượng sử dụng Victoza dài hạn (26 tuần hoặc lâu hơn) trong các thử nghiệm có đối chứng. Những phản ứng này thường nhẹ.
- Viêm tụy: Đã có báo cáo vài trường hợp viêm tụy cấp (< 0,2%) trong các thử nghiệm dài hạn với Victoza. Viêm tụy cũng được báo cáo trong giai đoạn hậu mãi.
- Phản ứng dị ứng: Các phản ứng dị ứng bao gồm nổi mề đay, nổi ban và ngứa đã được báo cáo với việc sử dụng Victoza khi thuốc đã lưu hành trên thị trường.
- Ít trường hợp phản ứng phản vệ với các triệu chứng kèm theo như hạ huyết áp, đánh trống ngực, khó thở, phù đã được báo cáo với việc sử dụng Victoza khi thuốc lưu hành trên thị trường. Ít trường hợp phù mạch (0,05%) đã được báo cáo trong các thử nghiệm dài hạn với Victoza.
- Báo cáo phản ứng ngoại ý nghi ngờ: Báo cáo phản ứng ngoại ý nghi ngờ sau khi sản phẩm thuốc được cấp phép lưu hành là rất quan trọng. Việc này cho phép giám sát liên tục cân bằng lợi ích/nguy cơ của các sản phẩm thuốc. Các nhân viên y tế được yêu cầu báo cáo bất kỳ trường hợp nghi ngờ phản ứng ngoại ý nào thông qua hệ thống báo cáo quốc gia.
Thông báo cho bác sĩ những tác dụng không mong muốn gặp phải khi sử dụng thuốc.
Tương tác với các thuốc khác
- Trong phòng thí nghiệm, liraglutide cho thấy rất ít khả năng có tương tác dược động học với các hoạt chất liên quan đến cytochrome P450 và gắn kết với protein huyết tương.
- Hiện tượng chậm làm rỗng dạ dày nhẹ khi dùng liraglutide có thể ảnh hưởng đến sự hấp thu các thuốc dạng uống dùng đồng thời. Các nghiên cứu về tương tác không cho thấy bất kỳ sự chậm hấp thu nào có ý nghĩa lâm sàng và do vậy không cần điều chỉnh liều. Một vài bệnh nhân được điều trị bằng liraglutide đã báo cáo có ít nhất một đợt tiêu chảy nặng. Tiêu chảy có thể ảnh hưởng đến sự hấp thu các thuốc dạng uống dùng đồng thời.
- Warfarin và các dẫn xuất coumarin khác: Chưa có nghiên cứu nào về tương tác được thực hiện. Không loại trừ được tương tác có ý nghĩa lâm sàng với các hoạt chất có độ tan kém hoặc chỉ số điều trị hẹp như warfarin. Khi khởi đầu điều trị bằng liraglutide ở những bệnh nhân đang dùng warfarin hoặc các dẫn xuất coumarin khác, khuyến cáo theo dõi tỷ số chuẩn hóa quốc tế (INR) thường xuyên hơn.
- Paracetamol: Liraglutide không làm thay đổi mức tiếp xúc tổng thể của paracetamol sau khi dùng một liều đơn 1000 mg. Nồng độ cao nhất trong huyết tương (Cmax) của paracetamol giảm 31% và trung vị thời gian đạt được nồng độ cao nhất trong huyết tương (tmax) chậm đến 15 phút. Không cần điều chỉnh liều khi dùng đồng thời với paracetamol.
- Atorvastatin: Liraglutide không làm thay đổi mức tiếp xúc tổng thể của atorvastatin có ý nghĩa lâm sàng sau khi dùng một liều đơn atorvastatin 40 mg. Vì vậy không cần điều chỉnh liều atorvastatin khi dùng với liraglutide. Cmax của atorvastatin giảm 38% và tmax trung vị chậm từ 1-3 giờ khi dùng với liraglutide.
- Griseofulvin: Liraglutide không làm thay đổi mức tiếp xúc tổng thể của griseofulvin sau khi dùng một liều đơn griseofulvin 500 mg. Cmax của griseofulvin tăng 37% trong khi tmax trung vị không thay đổi. Không cần điều chỉnh liều griseofulvin và các hợp chất khác có độ tan thấp và độ thẩm thấu cao.
- Digoxin: Dùng một liều đơn digoxin 1 mg với liraglutide dẫn đến giảm diện tích dưới đường cong (AUC) của digoxin 16%; Cmax giảm 31%. Trung vị thời gian đạt nồng độ tối đa (tmax) của digoxin chậm lại từ 1 giờ đến 1,5 giờ. Dựa trên những kết quả này, không cần điều chỉnh liều digoxin.
- Lisinopril: Dùng một liều đơn lisinopril 20 mg với liraglutide dẫn đến giảm AUC của lisinopril 15%; Cmax giảm 27%. Trung vị thời gian đạt nồng độ tối đa (tmax) của lisinopril chậm lại từ 6 giờ đến 8 giờ khi dùng với liraglutide. Dựa trên những kết quả này, không cần điều chỉnh liều lisinopril.
- Các thuốc tránh thai dạng uống: Liraglutide làm giảm Cmax của ethinyloestradiol và levonorgestrel lần lượt là 12% và 13% , sau khi dùng một liều đơn thuốc tránh thai dạng uống. Tmax chậm 1,5 giờ khi dùng liraglutide đối với cả hai hợp chất. Không có ảnh hưởng có ý nghĩa lâm sàng nào đối với mức độ tiếp xúc tổng thể ethinyloestradiol hoặc levonorgestrel. Vì vậy tác dụng tránh thai được dự đoán không bị ảnh hưởng khi dùng kết hợp với liraglutide.
- Insulin: Không quan sát thấy tương tác dược động học hoặc dược lực học giữa liraglutide và insulin detemir khi sử dụng một liều đơn insulin detemir 0,5 U/kg với liraglutide 1,8 mg ở trạng thái ổn định cho bệnh nhân đái tháo đường típ 2.
Lưu ý khi sử dụng (Cảnh báo và thận trọng)
- Thuốc này chỉ dùng theo đơn của bác sĩ.
- Không nên dùng liraglutide ở bệnh nhân bị đái tháo đường típ 1 hoặc để điều trị nhiễm toan ceton do đái tháo đường.
- Liraglutide không phải là thuốc thay thế cho insulin.
- Kinh nghiệm còn hạn chế ở bệnh nhân bị suy tim sung huyết độ I-II theo phân loại của Hiệp hội Tim New York (NYHA), vì vậy cần thận trọng khi sử dụng liraglutide. Chưa có kinh nghiệm ở bệnh nhân bị suy tim sung huyết độ III-IV theo phân loại của Hiệp hội Tim New York (NYHA) và do vậy liraglutide không được khuyên dùng ở những bệnh nhân này.
- Kinh nghiệm còn hạn chế ở bệnh nhân bị viêm ruột và liệt dạ dày do đái tháo đường.
- Không khuyên dùng liraglutide ở những bệnh nhân này do sử dụng liraglutide có liên quan với các phản ứng phụ về đường tiêu hóa thoáng qua bao gồm buồn nôn, nôn và tiêu chảy.
Nguy cơ về khối u tế bào tuyến giáp:
- Khi thử nghiệm trên chuột cống và chuột nhắt ở cả 2 giống đực và cái, liraglutide gây ra khối u tế bào tuyến giáp (u tuyến và/hoặc ung thư biểu mô) phụ thuộc vào thời gian dùng và liều dùng. Ung thư tế bào tuyến giáp ác tính được phát hiện trên chuột cống và chuột nhắt. Không rõ liệu Victoza có gây khối u tế bào tuyến giáp, bao gồm ung thư biểu mô tuyến giáp thể tủy ở người hay không vì chưa xác định được sự liên quan về khối u tế bào tuyến giáp gây ra bởi liraglutide trên loại động vật gặm nhấm và trên người.
- Các trường hợp ung thư biểu mô tuyến giáp thể tủy ở bệnh nhân được điều trị bằng Victoza đã được báo cáo sau khi đưa sản phẩm ra thị trường; dữ liệu trong các báo cáo này không đủ để thiết lập hay loại trừ mối liên hệ giữa ung thư biểu mô tuyến giáp thể tủy với việc sử dụng Victoza ở người.
- Victoza chống chị định cho những bệnh nhân có tiền sử bản thân hoặc gia đình bị ung thư biểu mô tuyến giáp thể tủy hoặc bệnh nhân đang bị hội chứng tăng sinh đa tuyến nội tiết típ 2 (MEN2).
- Khuyến cáo bệnh nhân về nguy cơ ung thư biểu mô tuyến giáp khi sử dụng Victoza và thông báo cho họ biết về các triệu chứng của khối u tuyến giáp (ví dụ: thấy bướu ở trong cổ, khó nuốt, khàn giọng dai dẳng). Định kỳ kiểm tra hàm lượng calcitonin trong huyết thanh hay siêu âm tuyến giáp không có giá trị chắc chắn để phát hiện sớm ung thư biểu mô tuyến giáp thể tủy ở bệnh nhân được điều trị bằng Victoza. Do tính đặc hiệu của phép định tính calcitonin huyết thanh thấp và tỷ lệ mắc bệnh tuyến giáp cao nên không cần thiết thực hiện việc theo dõi này. Tăng đáng kể lượng calcitonin trong huyết thanh có thể là chỉ thị của ung thư biểu mô tuyến giáp thể tủy và bệnh nhân ung thư biểu mô tuyến giáp thể tủy thường có hàm lượng calcitonin >50 ng/L. Nếu lượng calcitonin trong huyết thanh được đo và thấy tăng, bệnh nhân cần được đánh giá thêm. Bệnh nhân có bướu giáp phát hiện khi kiểm tra sức khỏe hay siêu âm cổ nên được kiểm tra thêm.
- Không dùng chung bút tiêm giữa các bệnh nhân: Bút tiêm Victoza không được dùng chung cho các bệnh nhận, ngay cả khi dùng kim riêng. Việc dùng chung có thể dẫn tới nguy cơ lây nhiễm các bệnh lây qua đường máu.
- Suy thận: Không thấy Victoza có độc tính thận trực tiếp ở các nghiên cứu trên động vật và các thử nghiệm lâm sàng. Một số báo cáo sau bán hàng về tình trạng suy thận cấp và nặng thêm ở bệnh nhân suy thận mãn, khiến phải lọc máu ở các bệnh nhân điều trị bằng Victoza. Trong số các bệnh nhân được báo cáo này, có một số bệnh nhân không có bệnh thận cơ bản. Phần lớn các trường hợp, bệnh nhân có buồn nôn, nôn, tiêu chảy hoặc mất nước. Một số trường hợp bệnh nhân dùng một hoặc nhiều thuốc ảnh hưởng đến chức năng thận hay tình trạng hydrat hóa. Chức năng thận được hồi phục ở rất nhiều trường hợp khi được điều trị hỗ trợ và ngừng sử dụng các tác nhân có thể gây nên, bao gồm Victoza. Thận trọng khi bắt đầu sử dụng hay tăng liều Victoza ở bệnh nhân suy thận.
Phản ứng quá mẫn:
- Có báo cáo sau bán hàng về phản ứng quá mẫn nghiêm trọng (ví dụ sốc mẫn cảm và phù mạch) ở bệnh nhân dùng Victoza. Nếu xảy ra các phản ứng quá mẫn, bệnh nhân nên ngừng sử dụng Victoza cũng như các thuốc nghi ngờ khác và nhanh chóng liên lạc để có lời khuyên về y khoa.
- Phù mạch cũng được báo cáo khi dùng các chất đồng vận thụ thể GLP-1. Thận trọng khi sử dụng ở bệnh nhân có tiền sử phù mạch khi dùng các chất đồng vận thụ thể GLP-1 khác bởi vì không rõ liệu bệnh nhân có bị phù mạch khi dùng Victoza hay không.
- Viêm tụy cấp: Việc sử dụng các chất đồng vận thụ thể GLP-1 có liên quan với nguy cơ phát triển viêm tụy cấp.
- Đã có vài báo cáo phản ứng phụ về viêm tụy cấp. Cần thông báo cho bệnh nhân về các triệu chứng đặc trưng của viêm tụy cấp. Nên ngừng dùng Victoza khi có nghi ngờ viêm tụy và không nên tiếp tục dùng lại Victoza nếu chẩn đoán xác định viêm tụy cấp. Cần thận trọng ở những bệnh nhân có tiền sử viêm tụy.
- Bệnh về tuyến giáp: Các phản ứng phụ về tuyến giáp, bao gồm tăng calcitonin huyết, bướu giáp và khối u tân sinh tuyến giáp đã được báo cáo trong các thử nghiệm lâm sàng, đặc biệt ở những bệnh nhân có bệnh về tuyến giáp từ trước, và do vậy liraglutide nên được sử dụng thận trọng.
- Hạ đường huyết: Những bệnh nhân đang dùng liraglutide phối hợp với một sulphonylurea hoặc một insulin nền có thể tăng nguy cơ bị hạ đường huyết (xem Tác dụng ngoại ý). Có thể làm giảm nguy cơ hạ đường huyết bằng cách giảm liều sulphonylurea hoặc insulin nền.
- Mất nước: Các dấu hiệu và triệu chứng của mất nước, bao gồm cả suy thận và suy thận cấp đã được báo cáo ở những bệnh nhân được điều trị bằng liraglutide. Cần báo cho những bệnh nhân điều trị bằng liraglutide biết về nguy cơ bị mất nước tiềm ẩn liên quan đến các tác dụng phụ về tiêu hóa và có biện pháp phòng ngừa để tránh mất dịch.
Phụ nữ mang thai và cho con bú
Phụ nữ mang thai:
- Chưa có đủ dữ liệu về việc sử dụng liraglutide ở phụ nữ có thai.
- Các nghiên cứu trên động vật đã cho thấy độc tính trên sự sinh sản (xem An toàn tiền lâm sàng).
- Chưa rõ nguy cơ có thể có đối với người.
- Không được dùng liraglutide trong khi mang thai, thay vào đó việc sử dụng insulin được khuyến cáo. Nếu bệnh nhân muốn có thai hoặc phát hiện có thai, phải ngừng điều trị bằng Victoza.
Phụ nữ cho con bú:
- Chưa rõ liraglutide có được bài tiết vào sữa mẹ hay không. Các nghiên cứu trên động vật đã cho thấy sự truyền liraglutide và các chất chuyển hóa có quan hệ gần về cấu trúc qua sữa là thấp. Nghiên cứu tiền lâm sàng đã cho thấy có sự giảm tăng trưởng chuột con sơ sinh còn bú mẹ liên quan đến điều trị (xem An toàn tiền lâm sàng). Do còn thiếu kinh nghiệm, không được dùng Victoza trong khi cho con bú.
Khả năng sinh sản:
- Ngoài sự giảm nhẹ về số lượng thai làm tổ còn sống, nghiên cứu trên động vật không cho thấy tác hại đối với khả năng sinh sản.
Người lái xe và vận hành máy móc
- Tác động trên khả năng lái xe và vận hành máy móc: Victoza không có tác động hoặc có tác động không đáng kể trên khả năng lái xe và vận hành máy móc. Cần khuyên bệnh nhân thận trọng tránh bị hạ đường huyết trong khi lái xe và vận hành máy móc, đặc biệt khi Victoza được dùng phối hợp với một sulphonylurea hoặc một insulin nền.
Bảo quản
- Nơi khô, tránh ánh sáng, nhiệt độ dưới 30°C.
Đánh Giá - Bình Luận
- Đặt đơn thuốc trong 30 phút. Gửi đơn
- Giao nhanh 2H nội thành HCM Chính sách giao hàng 2H.
- Mua 1 tặng 1 Đông Trùng Hạ Thảo Famitaa. Xem ngay
- Mua Combo giá tốt hơn. Ghé ngay
- Miễn phí giao hàng cho đơn hàng 700K
- Đổi trả trong 6 ngày. Chính sách đổi trả